Alphabet der Heimatkunde

| Startseite | Graphiken | Kaleidoskop | Touristisches |
 |
Heimatkunde |
|
Bei der Diskussion um das klassische Verfahren der
Messingherstellung (Kupfer,
lokalhistorischer Kontext)
taucht bezüglich der im Tiegel freiwerdenden
Zinkdämpfe
häufig die Frage auf, wieso man das Gemenge aus Galmei,
Holzkohle
u. Kupfer so weit erhitzte, dass der Siedepunkt des Zinks
überschritten
wurde.
Diese häufig gestellte Frage resultiert offenkundig aus der Vorstellung, man könne die Metalle aus den Erzen ausschmelzen. Unglücklicherweise entspricht diese Vorstellung einer allgemeinen, sehr missverständlichen Sprachgepflogenheit, die geflissentlich ignoriert, dass die im Erz enthaltenen Metalle (sieht man von einigen Sonderfällen wie beispielsweise Gold ab) nicht in elementarer Form, sondern als chemische Verbindungen vorliegen. Das heißt: Die Erzverhüttung ist in Wirklichkeit kein reiner Schmelzprozess, sondern in erster Linie ein chemischer Vorgang.
Unabhängig davon, ob Kupfer-, Blei-, Silber-, Eisen-, oder sonstige Erze nach der klassischen Methode verhüttet werden, ist das auf Reduktion basierende Verfahren immer gleich. Auch Zink bildet hierbei keine Ausnahme, obschon es, im Gegensatz zu anderen Metallen, eben nicht in flüssiger Form, sondern als Metalldampf freigesetzt wird.
 Zelliger Galmei aus den Lagerstätten um Stolberg. Sammlung u. Foto: F. Holtz |
Der Galmei (Sammelbegriff für nicht-sulfidische, also schwefelfreie Zinkerze) kommt häufig als Zinkspat vor, der in der Mineralogie auch Smithsonit genannt wird. Auf Grund seiner chemischen Zusammensetzung lässt sich der Zinkspat (ZnCO3) als Zinkcarbonat einordnen. Die Freisetzung des Zinks aus dem Galmei bzw. aus dem Zinkcarbonat wird mit folgender Reaktionsgleichung beschrieben.
Hierbei handelt es sich um eine Summenformel, die bezüglich der einzelnen chemischen Vorgänge naturgemäß recht vage bleibt.
Die beiden Komponenten des Zinkcarbonats, nämlich das Zinkoxid (ZnO) u. das Kohlendioxid (CO2), können durch starkes Erhitzen (Brennen) des Zinkspates getrennt werden, wobei das Kohlendioxid entweicht.
Dieser Vorgang des sogenannten Kalzinierens lief häufig als separater Prozess-Schritt in hierfür speziell ausgelegten Brennöfen ab. Im Falle des direkten Einsatzes von unkalziniertem Zinkspat im Messingofen erfolgte das Freisetzen des Kohlendioxids im Schmelztiegel beim Aufheizen der Charge, wobei das flüchtige Kohlendioxid, ähnlich wie im Kalzinierofen, aus dem Tiegel entweichen konnte. Die im Tiegel verbleibende Restmenge des aus dem Galmei freiwerdenden Gases wurden in der nachfolgenden Prozessphase zu Kohlenmonoxid reduziert.

Letztlich bildete sich aus dem so gewonnenen Zinkoxid durch Reaktion mit dem Kohlenstoff (Holzkohle) elementares Zink und Kohlenmonoxid.
Auch bei dieser Reaktionsgleichung handelt es sich um eine Summenformel, hinter der sich eine Kombination aus zwei Einzelreaktionen verbirgt. Bei beiden Reaktionspartnern, nämlich Zinkoxid und Kohlenstoff handelt es sich um Feststoffe, die nicht unmittelbar und direkt miteinander reagieren können.
Eingeleitet wird der Reaktionsablauf durch das im Tiegel befindliche Kohlendioxid, welches durch das Kalzinieren des Galmeis und/oder durch die Reaktion von Luftsauerstoff mit der Holzkohle (Verbrennung) beim Aufheizen der Charge gebildet worden war. Mit steigender Temperatur entsteht aus dem Kohlendioxid in Verbindung mit dem Kohlenstoff in zunehmenden Maße Kohlenmonoxid.
|
|
CO2 + C → 2CO |
Das so gebildete Kohlenmonoxid kann jetzt dem Zinkoxid den Sauerstoff entziehen, so dass elementares Zink freigesetzt wird.
|
|
ZnO + CO → Zn + CO2 |
Das so entstandene Kohlendioxid wird entsprechend Gleichung (a) erneut zu Kohlenmonoxid umgesetzt, welches gemäß Gleichung (b) zu einer weiteren Reduktion des Zinkoxids führt. Der überschüssige Teil des Gasgemisches aus Kohlenmonoxid und Kohlendioxid entweicht aus dem Tiegel, wobei das Kohlenmonoxid mit dem Luftsauerstoff zu Kohlendioxid aufoxidiert wird.
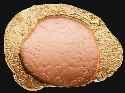 |
Kupfer, am
äußeren Rand zu Messing umgebildet. Sammlung: F. Holtz, Foto: RWTH Aachen |
Die in Gleichung (b) beschriebene Reaktion ist nun allerdings reversibel. Das heißt: Bereits gebildetes elementares Zink kann in Verbindung mit vorhandenem Kohlendioxid durchaus wieder nach Zinkoxid zurückverwandelt werden.
Mit anderen Worten: Die Anwesenheit von Kohlendioxid ist für den Ablauf des Prozesses äußerst ungünstig. Es muss also dafür gesorgt werden, dass sich im System möglichst wenig Kohlendioxid befindet. Auch das bei der Reduktion des Zinkoxids gebildete Kohlendioxid muss folglich möglichst schnell und vollständig wieder zu Kohlenmonoxid umgesetzt werden. Unter der Voraussetzung, dass hinreichend Kohlenstoff zur Verfügung steht, ist das Mengenverhältnis zwischen Kohlenmonoxid und Kohlendioxid von der Prozesstemperatur abhängig und wird durch das sogenannte Boudouard-Gleichgewicht bestimmt.
Wie in beiliegendem Diagramm
ersichtlich, wird das Kohlendioxid bei steigender Temperatur in
zunehmendem Maße durch Kohlenmonoxid ersetzt. Ein Diagrammausschnitt
für den oberen Temperaturbereich
lässt erkennen,
dass der Kohlenmonoxid-Gehalt kurz unterhalb der Siedetemperatur des
Zinks von 907oC
bei etwa 97% liegt. Der noch verbleibende Kohlendioxid-Anteil von ca.
3% lässt sich durch eine weitere Temperaturerhöhung
auf etwa
950oC
nochmals halbieren. Für das in der Literatur
häufig angegebene, zum Messingbrennen erforderliche
Temperaturniveau
von über 950oC ergibt sich somit ein
Kohlendioxid-Anteil
von nur noch 1.5% oder weniger.
Aus diesen Betrachtungen wird einsichtig und plausibel, dass man sich beim Messingbrennen eben nicht an der Siedetemperatur des Zinks orientieren konnte, sondern einen Temperaturbereich erreichen musste, der einen Kohlenmonoxid-Gehalt von nahezu 100% gewährleistete.
| Startseite | Graphiken | Kaleidoskop | Touristisches |