Sodaherstellung und
Chemische Fabrik
Rhenania
Eigentlich sind es ja bereits alte Bekannte, die chemische
Fabrik Rhenania und ihre Vorgängerin, die
Waldmeisterhütte.
Und beide hatten durch Pionierarbeit in der Rösttechnik auch
schon erkennen lassen, dass sie auf dem Gebiet der Hochtechnologie
mithalten und teilweise sogar anführen konnten. Diese
Technologiekompetenz
erstreckte sich (fast möchte man sagen
selbstverständlich)
auch auf die Verfahren, die zur Sodaherstellung angewandt wurden
und gleichfalls auf Folge- und Nebenprozesse, die der Sodaherstellung
angegliedert waren.

|
Quelle: Rüsberg F: (1949)
Die Rhenania in den 1940er Jahren
(Archiv: H. Beckers, Bestand: Nachlass
Maria May) |
Gegründet worden war die Waldmeisterhütte
von dem
Apotheker Friedrich Wilhelm Hasenclever,
der kurze Zeit später auch Mitbegründer der
Nachfolgegesellschaft
'Chemische Fabriken Rhenania' gewesen war, und der innerhalb dieses
Unternehmens am Anfang einer langen Familiendynastie gestanden
hat. Als nämlich Friedrich Wilhelm Hasenclever 1874 verstarb,
übernahm der bereits als Ingenieur im Unternehmen
tätige
Robert Hasenclever die Firmenleitung. Nach dessen Tod wurde im
Jahr 1902 ein dreiköpfiges Direktorium mit der
Unternehmensleitung
betraut, dem wiederum Max Hasenclever bis 1939 angehörte.
Zu Anfang des 20. Jahrhunderts wurde auch in der
Großchemie
ein gewisser Zwang zur Konzentration spürbar, ein Trend,
dem sich auch die Rhenania nicht entziehen konnte. Bereits 1887
hatte sie Teile der 'Aktiengesellschaft für Chemische
Industrie'
in Mannheim Rheinau übernommen. 1917 brachte die Rhenania
die 'Chemischen Fabriken Hönningen' (Rhein) in ihren Besitz
und begründete im gleichen Jahr zusammen mit den 'Deutschen
Kaliwerken' die 'Claus - Schwefel GmbH' in Bernburg. Hierauf erfolgte
1920 der Zusammenschluss der 'Chemischen Fabriken Kunheim' und
der Rhenania.

Skizze: F. Holtz
1928 fusionierten dann der 'Rhenania - Kunheim Verein
Chemischer
Fabriken' und die 'Kaliwerke Neustraßfurt - Friedrichshall'
zu einem Großunternehmen der chemischen Industrie, das unter
dem Namen 'Kali - Chemie' firmierte. Letztlich hatte sich somit
eine Unternehmenskonstellation entwickelt, in der sich sowohl
die Sodaherstellung als auch die hierzu erforderliche Gewinnung
von Steinsalz in einer Hand befanden.
Doch jetzt wieder zurück zu den
Gründerjahren und
zu dem eigentlichen und ursprünglichen Unternehmensziel:
der Herstellung des Schlüsselproduktes Soda.
Hierzu waren, wie bereits erwähnt, Grundstoffe erforderlich,
die in ganz überwiegendem Maße in der hiesigen
Region
zur Verfügung standen. Lediglich Koch- bzw. Steinsalz, das
mengenmäßig zu nur etwa 15% an der Sodaherstellung
beteiligt war, musste von auswärts herantransportiert werden.

Skizze: F. Holtz
Lässt man den Röstprozess und die hieran
gekoppelte
Schwefelsäureherstellung,
welche als eigentliches Bindeglied zwischen den
Hüttenbetrieben
und der Großchemie fungierte, hier einmal außer
Betracht,
so kann die Herstellung von Soda in sechs Teilprozesse untergliedert
werden, die als Kurzübersicht wie folgt aufgeführt
sind:
- Umsatz von Stein- (Koch-) Salz und Schwefelsäure
zu Natriumsulfat.
- Reduktion von Natriumsulfat zu Natriumsulfid
und Umwandlung des Natriumsulfids mit Kalkstein zur
so genannten Schwarzasche
(Rohsoda).
- Auslösung der eigentlichen Soda aus der
Schwarzasche mittels Wasser.
- Filtration der Sodalauge zur Abtrennung fester
Schwebstoffanteile.
- Eindampfen der Lauge bis zur Kristallisation und Trennung
der Kristallsoda von der Mutterlauge durch Filtration.
- Austreiben der Wasseranteile durch Erhitzen (kalzinieren).
Diese Prozessschritte bildeten in ihrer Gesamtheit das so
genannte
'Leblanc'-Verfahren,
das sowohl von seiner Bedeutung als auch von seinen Auswirkungen
her durchaus interessant genug ist, sich etwas eingehender damit
zu befassen und ebenfalls die Teilprozesse etwas näher zu
beleuchten.
Der Prozessabfolge entsprechend steht als nächstes
jetzt
der Natriumsulfatofen zur Diskussion. Es sei bereits hier darauf
hingewiesen, dass an diesem Ofentyp ganz besonders ungesunde,
geradezu schreckliche Arbeitsbedingungen vorlagen, unter welchen
zudem noch körperliche Schwerstarbeit geleistet werden musste.
Davon wird jedoch in einem späteren Kapitel noch eingehender
berichtet werden.
Natriumsulfat-Ofen
Natriumsulfat war einer der Ausgangsstoffe für die
Sodaherstellung
und konnte aus Schwefelsäure und Kochsalz gewonnen werden.
Bei diesem Prozess wurde Chlorwasserstoff
(Salzsäuregas) frei, wodurch man sich anfänglich
ähnlichen
Problemen gegenübergesehen hatte wie beim Abrösten
der
Blende. Allerdings waren diese Probleme bereits gelöst, als
das Verfahren in Stolberg Anwendung fand.
Zunächst war man mit der Einführung des
Leblanc-Verfahrens
nämlich vom Regen in die Traufe geraten. Die
Schwefeldioxydbelastung
war zwar durch die Nutzung der Röstgase zur
Schwefelsäureherstellung
drastisch reduziert worden, dafür aber hatte man jetzt das
(eigentlich noch viel schlimmere) Problem mit den
Salzsäuregasen.
Auch die recht vordergründige und höchst
fragwürdige
Politik der hohen Schornsteine wollte hier nicht fruchten, da
sich das Salzsäuregas unter Aufnahme von Luftfeuchtigkeit
zu kompakten Wolken verdichtete, die schwerer waren als die
Umgebungsluft
und daher sofort und in unmittelbarer Nähe der
Produktionsanlagen
zu Boden sanken. Und wie das damals so üblich war, und heute
wohl auch noch manchmal der Fall ist, wurde dieses Problem ebenfalls
hauptsächlich deshalb gelöst, weil man für
das
Salzsäuregas eine Verwendung fand. Die Entlastung der Umwelt
war zwar willkommender Nebeneffekt, aber eigentlich nicht direkter
Auslöser für die Entwicklung der
Problemlösung
gewesen. Der Lösungsansatz wies starke Ähnlichkeit
mit
dem Prinzip auf, das letztlich auch bei den Röstöfen
Verwendung fand. Ebenfalls beim Natriumsulfat- Ofen musste das
freiwerdende Salzsäuregas völlig getrennt gehalten
werden
von den Verbrennungsgasen, da sich der reine Chlorwasserstoff
ansonsten nur schwerlich kondensieren ließ.

Skizze: F. Holtz
Die gusseiserne Schale, die oberhalb des Feuerraumes
angeordnet
war, wurde mit Kochsalz und Schwefelsäure beschickt, und
diente gleichzeitig als Abschottung des Gasraumes vom Brennraum.
Zur Trennung der aus der Pfanne ausgebrachten Natriumsulfat-Charge
vom Feuerraum und zu deren Endbehandlung fand wiederum der bereits
mehrfach beschriebene Trick mit der Muffel Verwendung. Somit konnte
der freigesetzte Chlorwasserstoff gänzlich aufgefangen werden,
sieht man einmal von den Restmengen ab, die durch die
Arbeitsöffnungen
entweichen konnten. Letztere waren erforderlich, weil die Chargen
mittels schwerer Eisenstangen mehrfach umgerührt und dann
in die Muffel hineingeschoben werden mussten.
Der Prozess war bezüglich der
Temperaturführung,
der Verweilzeit und der Handhabung (Beschickung und Ausbringung
der Chargen) äußerst kritisch. Leichte
Unachtsamkeiten
oder Fehler in der Arbeitsweise konnten die eingesetzte Rohstoffmenge
sehr schnell verderben, so dass nicht nur körperliche
Kraftanstrengung,
sondern auch Geschicklichkeit und Zuverlässigkeit des
Bedienungspersonals
unabdingbar waren.
Der Soda-Ofen
Das eben gesagte galt in fast noch höherem Maße
für
den Leblanc-Handofen, der zunächst für den
eigentlichen
Sodaprozess Verwendung fand, später jedoch von
Drehrohröfen
(Soda-Revolver)
abgelöst wurde.
Insbesondere bei den Handöfen war die Beurteilung des
Schmelzzustandes äußerst kritisch und verlangte viel
Erfahrung. Der richtige Zeitpunkt zum Abziehen der fertigen Charge
musste minutengenau abgeschätzt werden und
geringfügige
Abweichungen in der Verweilzeit, in der Temperatur oder im Ofenzug
machten die Schmelze unbrauchbar.
Ganz wichtig war auch das sorgsame und gründliche
Umkrücken
(Durcharbeiten) der Masse, um erstens eine gute und
gleichmäßige
Erwärmung zu erzielen und zweitens die unterschiedlichen
Bestandteile der Masse in möglichst direktem Kontakt
zueinander
zu bringen, da nur so eine vollständige Reaktion
möglich
wurde. Und ähnlich wie beim Natriumsulfat-Ofen erforderte
dieses Umkrücken nicht nur Geschicklichkeit, sondern auch
große Kraftanstrengung, die überdies auch noch bei
großer Hitze zu erbringen war.
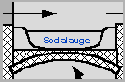
Skizze: F. Holtz
|
Bei dem hier gezeigten Ofentyp
wurde die Abwärme zum Eindampfen von Sodalauge genutzt (rechte
Skizzenseite). |
Das Gemenge aus Natriumsulfat, Kohle und gemahlenem Kalkstein
wurde zunächst bei mäßiger Hitze umgesetzt
und
nach Ablauf der Reaktion zum feuerseitigen Ofenteil gezogen. Hier
wurde das Material dann auf helle Rotglut erhitzt und als Schwarzasche
(Rohsoda) ausgebracht. Der Ofen besaß seitliche
Arbeitsöffnungen
zum Umkrücken, zum Verlagern des Materials von der einen
Ofenplattform zur anderen und zum Abziehen der fertigen Charge.
Die im Reaktionsgemisch eingesetzte Kohle diente als
Reduktionsmittel
(zur Bindung des Sauerstoffes) bei der Umwandlung von Natriumsulfat
nach Natriumsulfid. Letzteres bildete durch Reaktion mit dem Kalkstein
die Schwarzasche, ein Gemisch aus Soda und Kalziumsulfid.
Beide Substanzen waren in der Schwarzasche innig vermengt, konnten
jedoch durch Auslaugen sehr einfach getrennt werden, da die Soda
im Gegensatz zum Kalziumsulfid leicht wasserlöslich ist.

|
Quelle: Tomlinson C. (1848):
Auslaugen der Soda aus der Schwarzasche. Hierzu fanden
größere, wassergefüllte Behälter
Verwendung. |
Nach dem Auslaugen der Soda aus der Schwarzasche verblieb als
Reststoff ein Gemisch aus Kalziumsulfid, Asche, Kalk- und Kohlereste;
eine graue, nach faulen Eiern stinkende Mixtur, mit der man nichts
anzufangen wusste. Diese Masse wurde als lästiges
Abfallprodukt
auf Halden deponiert (z. B. Rhenania Halde Atsch), und diese Tatsache
war aus heutiger Sicht das eigentliche Problem des Leblanc-Prozesses.
Der weitaus problematischste Bestandteil dieses Abfallstoffes
war das Kalziumsulfid, aus dem beim Zusammentreffen mit
säurehaltigen
Wässern giftiger Schwefelwasserstoff freigesetzt wurde bzw.
wird, der in ganz erheblichem Maße die Luft verpestete.
Insbesondere die aus den Halden austretenden Sickerwässer
enthalten auch heute noch Schwefelverbindungen, die durch
Folgereaktionen
entstehen und die Gewässer belasten.
Während zur Betriebszeit der Sodafabriken reichlich
Säuregas
in der Luft vorhanden war, das für einen Umsatz des
Kalziumsulfids
sorgte, ist die Situation auch heute nicht grundlegend anders.
Die in der Luft enthaltene Kohlensäure hält den
übelriechenden
Prozess weiter in Gang, wie sich in der Gegend des Stolberger
Bahnhofs, wo die Rhenania einmal gestanden und ihre
Rückstände
deponiert hat, immer noch leicht und deutlich erschnuppern
lässt.
Je nach Sensibilität kann dieser Geruch durchaus auch als
belästigend und störend empfunden werden.
Wenn es auch zunächst so ausgesehen hatte, als ob die
technisch bedingten Umweltprobleme bei dem Gesamtkomplex Erze
und Soda mit Hilfe technischer Maßnahmen lösbar
seien,
ging diese Rechnung - wie so oft - letztlich doch nicht so ganz
auf. Die Probleme mit den Röstgasen und auch die mit den
Salzsäuregasen hatte man zwar durch Einsatz technischer Mittel
und sogar mit wirtschaftlichem Gewinn in den Griff bekommen, beim
Kalziumsulfid jedoch hat es eine ökologisch adäquate
Lösung eigentlich nicht gegeben.
Zwar hatte man in Stolberg sehr früh schon und in
Deutschland
erstmalig damit begonnen, Schwefelrückgewinnung zu betreiben
und mit den hier entwickelten und eingesetzten Verfahren eigentlich
auch betriebswirtschaftlich interessante Ergebnisse erzielt. Trotzdem
blieben auch bei Anwendung von Schwefelrückgewinnungsverfahren
die Kalziumsulfid - Restmengen nach wie vor ein Problem, das geradezu
kennzeichnend gewesen ist für die Leblanc-Sodaindustrie.
Als man letztendlich ein ökologisch zufriedenstellendes
Verfahren
zur Entschwefelung gefunden hatte, war das Leblanc-Verfahren eigentlich
bereits technisch überholt.
Nebenprodukte der Leblanc-Industrie
Möglicherweise wird man sich erinnern, dass beim Umsatz von
Steinsalz und Schwefelsäure neben dem Natriumsulfat auch
Salzsäuregas (Chlorwasserstoff) entstand. Dieses
höchst
aggressive Gas hatte zunächst dort, wo es ungenutzt in die
Atmosphäre gelangte, starke Umweltbeeinträchtigungen
hervorgerufen. In Stolberg jedoch wurde das im Natriumsulfat-Ofen
anfallende Salzsäuregas (glücklicherweise) schon ganz
zu Anfang der Sodafabrikation zur Herstellung von Salzsäure
genutzt.
Hierzu leitete man das Salzsäuregas durch ein System
von
50 oder mehr hintereinandergeschalteten Behältern (auch
Tourils
genannt), die aus säurefestem Steinzeug gefertigt waren.
Diese Tourils waren bis etwa zur Hälfte mit Wasser bzw.
wässriger
Salzsäure gefüllt, welche das Touril- System
über
Verbindungsleitungen im Gegenstrom durchfloss. An der
Flüssigkeits-Oberfläche
nahm die wässrige Säure in den Tourils begierig
Salzsäuregas
auf (Kondensation) und konnte sich somit allmählich
aufkonzentrieren
bis eine 30 bis 35%-ige "Verdichtung" erreicht war.

Skizze: F. Holtz
Das Restgas wurde abschließend mittels Wasser
ausgewaschen,
wobei die hierbei entstehende, sehr dünne Säure als
Speisewasser für den Gegenstrom-Durchfluss in den Tourils
genutzt wurde.
Im Normalfall (Einsatz von Touril-Systemen) entstanden also
beim Leblanc-Prozess Salzsäure
und Sodalauge, wobei die Sodalauge üblicherweise zu
kristalliner
Soda weiterverarbeitet wurde. Die Salzsäure wiederum, ein
geradezu kennzeichnendes Nebenprodukt des Leblanc- Verfahrens,
fand in der chemischen Industrie zunehmend guten Absatz (z.B.
zur Gewinnung von Chlor oder zum Aufschluss von Knochen bei der
Leimherstellung).
Sodalauge und Salzsäure waren also die eigentlichen
Produkte
des Leblanc-Prozesses und beide Substanzen waren bestens geeignet,
die zunächst aus Kristallsoda und Salzsäure
bestehende
Angebotspalette durch höchst profitable Produkte zu erweitern.
Zur Weiterverarbeitung bestens geeignet, so hatte die Aussage
gelautet; eine Aussage, die nun allerdings nicht allgemeine
Gültigkeit
hatte, sondern - wie schon so oft in unserer Geschichte - vor
dem Hintergrund heimischer Standortfaktoren zu sehen ist. Zur
Weiterverarbeitung von Salzsäure und zur alternativen
Verwendung
der Sodalauge wurde ein Grundstoff benötigt, der schon bei
der Herstellung von Sodalauge beteiligt gewesen war, und der sich
von Anfang an fast wie ein roter Faden durch unsere Standortgeschichte
hindurchgezogen hat. Es war nämlich nochmal wieder der
Kalkstein
bzw. dessen Derivate, die in den Folgeprozessen zur Herstellung
weiterer Nebenprodukte Verwendung fanden.
So wurde bei der Herstellung von Chlorprodukten aus
Salzsäure
(z.B. Chlorkalk) zunächst Kalkmilch (eine Aufschwemmung von
gelöschtem Kalk in Wasser) zur Chlorgewinnung
benötigt.
Zur Chlorkalkherstellung selbst war dann ebenfalls wieder
gelöschter
Kalk erforderlich.
Chlorkalk fand hauptsächlich zur Chlorbleiche in der
Textilindustrie
Verwendung. Aber auch die Papierhersteller nahmen große
Mengen dieses Chlorkalkes ab, da sie auf Grund der extrem guten
Bleichwirkung dieses Produktes nicht mehr auf den Einsatz
weißer
Textil-'Lumpen' angewiesen waren, sondern nunmehr auch
eingefärbte
Textilreste verwenden konnten. Chlorkalk kam in untergeordnetem
Maße ebenfalls als Desinfektionsmittel zur Anwendung.
Und nochmals wieder unter Verwendung von Kalk, diesmal aber
in Verbindung mit der Sodalauge, ließ sich das zweite
wichtige
Nebenprodukt der Sodaindustrie gewinnen. Dieses Produkt, die Natronlauge,
wurde -
neben der Soda selbst - vorwiegend in der Seifen- und
Waschmittelindustrie
eingesetzt.
Zur Herstellung der Natronlauge wurden zunächst
große
Eisenkessel mit Sodalauge gefüllt und dann eiserne, mit
gebranntem
Kalk
gefüllte Sieb-
bzw. Korbeinsätze eingetaucht. Hierbei entstand sofort
gelöschter
Kalk, der sich mit der gelösten Soda zu Natronlauge und
Kalziumkarbonat
(Kalk) umsetzte. Da Kalk in Wasser kaum löslich ist, brauchte
die anfallende Natronlauge nur noch filtriert zu werden. Ganz
ähnlich wie bei der Sodalauge, konnte auch die Natronlauge
eingedampft werden, wobei festes Ätznatron
entstand, welches von der Rhenania ebenfalls vertrieben wurde.
Solvay, ein neues Verfahren zur Sodaherstellung
Im Laufe der 70-er Jahre des vorigen Jahrhunderts erreichte ein
nach seinem Erfinder Ernest Solvay benanntes Verfahren
zur Sodaherstellung einen Entwicklungsstand, der einen
großtechnischen
Einsatz in zunehmendem Maße erlaubte.
Bei diesem neuen Verfahren fand neben Steinsalz als
Ausgangsstoff
nicht mehr Schwefelsäure, sondern Ammoniak Verwendung, ein
Grund dafür, dass die nach diesem Verfahren gewonnene Soda
auch Ammoniak-Soda genannt wurde. Das hierzu erforderliche Ammoniak
musste von Gasfabriken oder Kokereien bezogen werden.
Sieht man von den verschiedenen Ausgangsstoffen einmal ab,
so bestand der eigentlich grundsätzliche Unterschied zwischen
den beiden Verfahren darin, dass die Reaktionen beim Leblanc-Verfahren
in der festen Phase bzw. in der Schmelze und bei vergleichsweise
hohen Temperaturen abliefen, während die Umsetzung beim Solvay
Verfahren mit sehr viel weniger Energieaufwand in wässriger
Lösung erfolgte. Hieraus ergab sich bei Anwendung des
Solvay-Verfahrens
eine Kokseinsparung von ca. 95%.
Durch die niedrigeren Reaktionstemperaturen unterlagen die
eingesetzten Apparaturen und Produktionsanlagen fernerhin einem
weniger hohen Materialverschleiß und erforderten geringere
Reparatur- und Wartungskosten.
Als weiterer Vorteil wäre anzumerken, dass das beim
Leblanc-
Verfahren anfallende, lästige Abfallprodukt Kalziumsulfid
bei der Herstellung von Ammoniak-Soda nicht entstand und somit
natürlich auch nicht entsorgt werden musste.
Mit einem Wort gesagt, das neue Verfahren war dem Leblanc-
Prozess technisch überlegen und besaß so
entscheidende
Vorteile, dass es nach 1880 die etablierte Leblanc-Methode
allmählich
zu verdrängen begann. Auch bei der Rhenania hatte man sich
mit dem neuen Solvay-Prozess beschäftigt, und der Chemiker
Honigmann hatte dort eine entsprechende Anlage zur Herstellung
von Ammoniak-Soda im Labormaßstab entwickelt. Die
Firmenleitung
jedoch lehnte den Bau einer Produktionsanlage ab und hielt an
dem herkömmlichen Verfahren der Sodaherstellung fest.
Die Entscheidung, das technisch überlegene Verfahren
nicht
innerhalb der Rhenania in großtechnischem Maße
einzusetzen,
deutet aus heutiger Sicht darauf hin, dass man die Bedeutung des
Solvay-Verfahrens in Stolberg unterschätzt haben muss. Die
grundsätzlichen Vorteile wird man (weil evident) mit
Sicherheit
wohl auch erkannt haben, kam jedoch bezüglich deren Wertigkeit
und Gewichtung zu einer Fehleinschätzung.
Es ist natürlich heute und in Kenntnis der weiteren
Entwicklung
sehr einfach, fast schon anmaßend, die damalige
Unternehmensentscheidung
als falsch hinzustellen; aber mit dieser Entscheidung hatte man
- wie wir heute wissen - die Weichen für die Zukunft objektiv
falsch gestellt. Es gab aber auch eine ganze Reihe von
Gründen,
die diese Fehleinschätzung erklären können
und
jene (an sich falsche) Entscheidung nachvollziehbar machen.
Zunächst hatte die Rhenania das Leblanc-Verfahren auf
einen weltweit anerkannt hohen, technischen Standard entwickelt.
Man arbeitete sehr ertragreich mit besonders leistungsfähigen
Anlagen, die zumeist im eigenen Hause konstruiert worden waren.
Hierzu gehörten beispielsweise:
- der Sodarevolver,
- die "Thelen"-Pfanne zum Eindampfen der Sodalauge, bei der
mittels mechanisch bewegter Kratzer ein Festbrennen der Soda verhindert
wurde,
- der Hasenclever'sche Zylinderapparat zur kontinuierlichen
Herstellung von Chlorkalk und
- die Schwefelrückgewinnung aus dem Abfallprodukt
Kalziumsulfid.
Auf Grund dieser überlegenen Technik konnte sich das
Leblanc-Verfahren
in Stolberg zunächst tatsächlich noch behaupten, und
die Unternehmensleitung zeigte sich wenig geneigt, diese ausgefeilte,
hochentwickelte Technik aufzugeben.
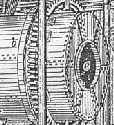
|
Quelle: Ost H. (1900):
Soda-Revolver. |
Obschon die technische Überlegenheit der
Solvay-Methode
aus heutiger Sicht völlig unstrittig ist, war dieses Verfahren
ohne jeden Zweifel sehr viel weniger auf die Gegebenheiten des
Standortes Stolberg zugeschnitten, eine Tatsache, die bei der
damaligen Unternehmensentscheidung ebenfalls eine Rolle gespielt
haben dürfte. Der deutlich weniger gute
Übereinstimmungsgrad
zwischen den Erfordernissen des Verfahrens und den vorgegebenen
Standortbedingungen bezog sich auf zwei Ausgangsstoffe, die zur
Sodaherstellung benötigt wurden.
Zunächst einmal war beim Solvay-Verfahren die
erforderliche
Einsatzmenge an Steinsalz zur Herstellung der gleichen Sodamenge
erheblich höher. Und, wie man sich erinnern wird, war
Steinsalz
der einzige Grundstoff, der aus entfernten Regionen herantransportiert
werden musste.
Als weiteres Problem ergab sich, dass bei der Anwendung des
Solvay- Verfahrens Ammoniak statt Schwefelsäure
benötigt
wurde, wobei letzteres (in Stolberg jedenfalls) in sehr viel geringerem
Maße verfügbar war. Und wenn man nun die
Produktionsanlagen
tatsächlich auf Ammoniak-Soda umgestellt hätte,
wäre
natürlich ganz massiv die Frage aufgetaucht, was man denn
mit der beim Abrösten der Erze weiterhin anfallenden
Schwefelsäure
hätte tun sollen.
Diese Frage war für die Rhenania von durchaus vitalem
Interesse, da man der Zinkindustrie weitreichende Abnahmegarantien
für Schwefelsäure gegeben hatte. Man musste also die
Schwefelsäure entweder selbst verarbeiten oder andere Abnehmer
finden. Von beiden Möglichkeiten machte die Rhenania
natürlich
konsequent Gebrauch.
Neben der Leblanc-Soda-Industrie waren
Düngemittelfabriken,
die Superphosphate herstellten, ebenfalls Großabnehmer
für
Schwefelsäure. In unmittelbarer Nachbarschaft der Rhenania
hatte sich eine derartige Kunstdüngerfabrik angesiedelt.
Dieses Unternehmen mit Namen A.
Schippan & Co. profitierte natürlich
ebenfalls von
der Schwefelsäure, die in unmittelbarer Nähe beim
Abrösten
der schwefelhaltigen Erze anfiel.
Auch hier lässt sich wiederum deutlich erkennen, wie
weitreichend
und vielfältig die Bedeutung der Stolberger Erze gewesen
ist, die über das Verbindungselement Schwefelsäure
auch
die Verfügbarkeit von Düngemitteln und somit sogar
die
Landwirtschaft beeinflusst haben.
Die Produktionsanlagen der Düngemittelfabrik Schippan
wurden 1920 durch eine schreckliche Explosion zerstört, die
23 Menschen das Leben kostete. Lange vorher jedoch war das Unternehmen
von der Rhenania mit dem Hauptziel übernommen worden, sich
den Absatz von Schwefelsäure zu sichern.
Wenn man die erforderlichen Grund- und Ausgangsstoffe mit in
die Betrachtung einbezieht, lässt sich zusammenfassend sagen,
dass der neue Solvay-Prozess technisch überlegen und wohl
auch besser geeignet, aber eben überhaupt nicht zugeschnitten
war auf die Gegebenheiten des Standortes Stolberg.
Die neue Methode zur Sodaherstellung hatte aber auch einen
ganz allgemeinen Nachteil, der darin bestand, dass das im Kochsalz
enthaltene Chlor an Kalzium gebunden wurde und sich damit
zunächst
jeglicher Nutzung entzog. Soweit sich das heute noch beurteilen
lässt, hat genau dieser Nachteil den Ausschlag dafür
gegeben, dass sich die Rhenania gegen das Solvay-Verfahren entschied.
Es war nämlich damals in der Soda-Industrie bereits
mehrfach
zu schweren Preiseinbrüchen gekommen, die teilweise so
drastisch
ausfielen, dass sie für eine Vielzahl von Unternehmen
existenzbedrohende
Krisen darstellten. Die wohl schwerste Krise wurde Anfang der
60-er Jahre durch den Ausbruch des Amerikanischen
Bürgerkrieges
(Sezessionskrieg) ausgelöst.
Der starken englischen Soda-Industrie ging durch die
Bürgerkriegsfolgen
in den Vereinigten Staaten ein wichtiges Absatzgebiet verloren,
und es gab aus den gleichen Ursachen einen starken Einbruch der
Baumwollproduktion, was eine stark rückläufige
Nachfrage
nach Soda zur Folge hatte. Die Engländer bedrängten
in zunehmendem Maße den europäischen Markt und
verursachten
einen regelrechten Preisverfall.
Die Rhenania hatte diese Krise relativ unbeschadet
überstanden,
weil man mit den Gewinnen aus dem Unternehmenszweig der Chlorprodukte
(in der Hauptsache Salzsäure) die Verluste abdecken konnte,
die sich aus den extrem niedrigen Sodapreisen ergaben.
Es ist also kaum verwunderlich, dass man wenig Neigung
verspürte,
einen Unternehmenszweig entscheidend zu schwächen, der gerade
in Krisenzeiten den Fortbestand des Gesamtunternehmens gesichert
hatte. Und ganz so falsch kann die Entscheidung wohl auch nicht
gewesen sein, denn die Produktion von Leblanc-Soda ist letztlich
doch noch bis 1925 in der Rhenania mit gutem Erfolg betrieben
worden.
Weiter








